Sie befinden sich hier
Inhalt
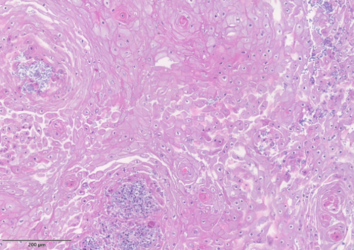
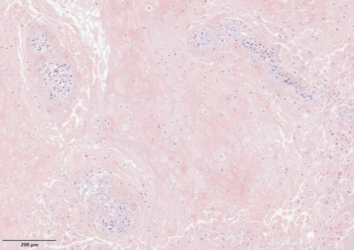
Ultrastrukturelle Untersuchung der Rolle des mitochondrialen Stoffwechsels beim Therapieansprechen von Kopf-Hals-Karzinomen im 3D-Tumormodell
Bei einer stark heterogenen Tumorentität wie dem Kopf-Hals-Karzinom (HNSCC) zeigen Tumorzellen oft einen veränderten Energiestoffwechsel. Sie sind stark auf die oxidative Phosphorylierung (OXPHOS) zur Herstellung von ATP in den Mitochondrien angewiesen. Unter Stress, etwa durch Bestrahlung oder Chemotherapien, können sie auf Glykolyse umschalten, um alternative Energie zu gewinnen.
Diese Veränderungen spielen eine wichtige Rolle beim Ansprechen und der Resistenzentwicklung von Krebstherapien und stehen deshalb im Fokus der Forschung.
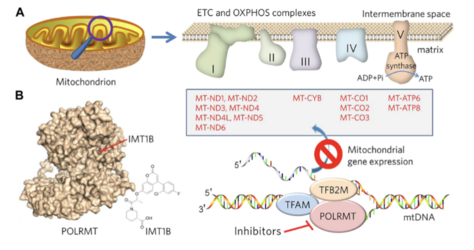
Um die Energieversorgung der Tumorzellen zu stören, werden Stoffe wie IMT1 und das Antibiotikum Doxycyclin eingesetzt. Sie hemmen die mitochondriale RNA-Polymerase (POLRMT) und damit die Herstellung wichtiger Proteine für die Energieproduktion in der OXPHOS.
Ein weiterer wichtiger Faktor ist das Transportprotein MDR1 (auch ABCB1 genannt). Es ist für den Medikamentenefflux zuständig und transportiert Cisplatin, ein gängiges Chemotherapeutikum in der Therapie von HNSCC, ATP-abhängig aus der Zelle heraus. Studien zeigen, dass eine geringere MDR1-Produktion mit weniger Rezidiven verbunden sein könnte. Es wird deshalb untersucht, ob man durch weniger ATP und mehr oxidativen Stress in der Zelle MDR1 hemmen und so die Wirkung von Chemotherapie verbessern kann.
Auch die Morphologie der Mitochondrien spielt eine Rolle:
- Fission (Teilung) kann Zellen anfälliger für den Zelltod machen.
- Fusion (Verschmelzung) hilft bei Reparatur, macht Zellen aber widerstandsfähiger.
Das Gleichgewicht zwischen Fission und Fusion ist entscheidend für das Überleben der Zellen und stellt einen möglichen Ansatzpunkt für neue personalisierte Therapien dar.
Mit Hilfe des 3D-ex-vivo-Tumormodellsystems, bei welchem kleine Gewebestücke eines Tumors über mehrere Tage kultiviert werden können, kann eine experimentelle Behandlung der Zellen in seiner Gesamtheit erfolgen und so eine Aussage über das Ansprechen der Zellen auf die Therapien erfolgen.
Förderung



Kooperationspartner
- Prof. Dr. med. Christoph Brochhausen-Delius, Direktor des Pathologischen Instituts, Universitätsmedizin Mannheim
- Prof. Dr. rer. nat. Jochen Hess, Hals-Nasen-Ohrenklinik, Universitätsklinik Heidelberg
- Anthony John Iafrate, MD, PhD, Department of Pathology, Massachusetts General Hospital, Boston, MA, USA
- Prof. Dr. Karen Bieback, Institut für Transfusionsmedizin und Immunologie, Medizinische Fakultät Mannheim und DRK-Blutspendedienst Baden-Württemberg-Hessen
- Prof. Dr. Aurelio Teleman, DKFZ, Deutsches Krebsforschungszentrum, Heidelberg
Publikationen
Yu, H.-J., Xiao, G.-L., Zhao, Y.-Y., Wang, X.-X., & Lan, R. (2021). Targeting Mitochondrial Metabolism and RNA Polymerase POLRMT to Overcome Multidrug Resistance in Cancer. Frontiers in Chemistry, 9. https://doi.org/10.3389/fchem.2021.775226