Noch immer sind Herzkreislauf-Erkrankungen (kardiovaskuläre Erkrankungen) in Deutschland und den meisten entwickelten Nationen die häufigste Ursache für Todesfälle. Mit Hochdruck werden daher neuartige Therapieoptionen zur Behandlung und Prävention kardiovaskulärer Erkrankungen erforscht. Für eine Vielzahl von kardiovaskulären Folgeerkrankungen ist die Atherosklerose, eine komplexe, degenerative Erkrankung der arteriellen Gefäßwände, ursächlich verantwortlich. Wissenschaftler:innen der Universitätsmedizin Mannheim (UMM) haben nun in den Scavenger-Rezeptoren Stabilin-1 und Stabilin-2 einen neuen Ansatzpunkt für die Behandlung der Atherosklerose entdeckt.
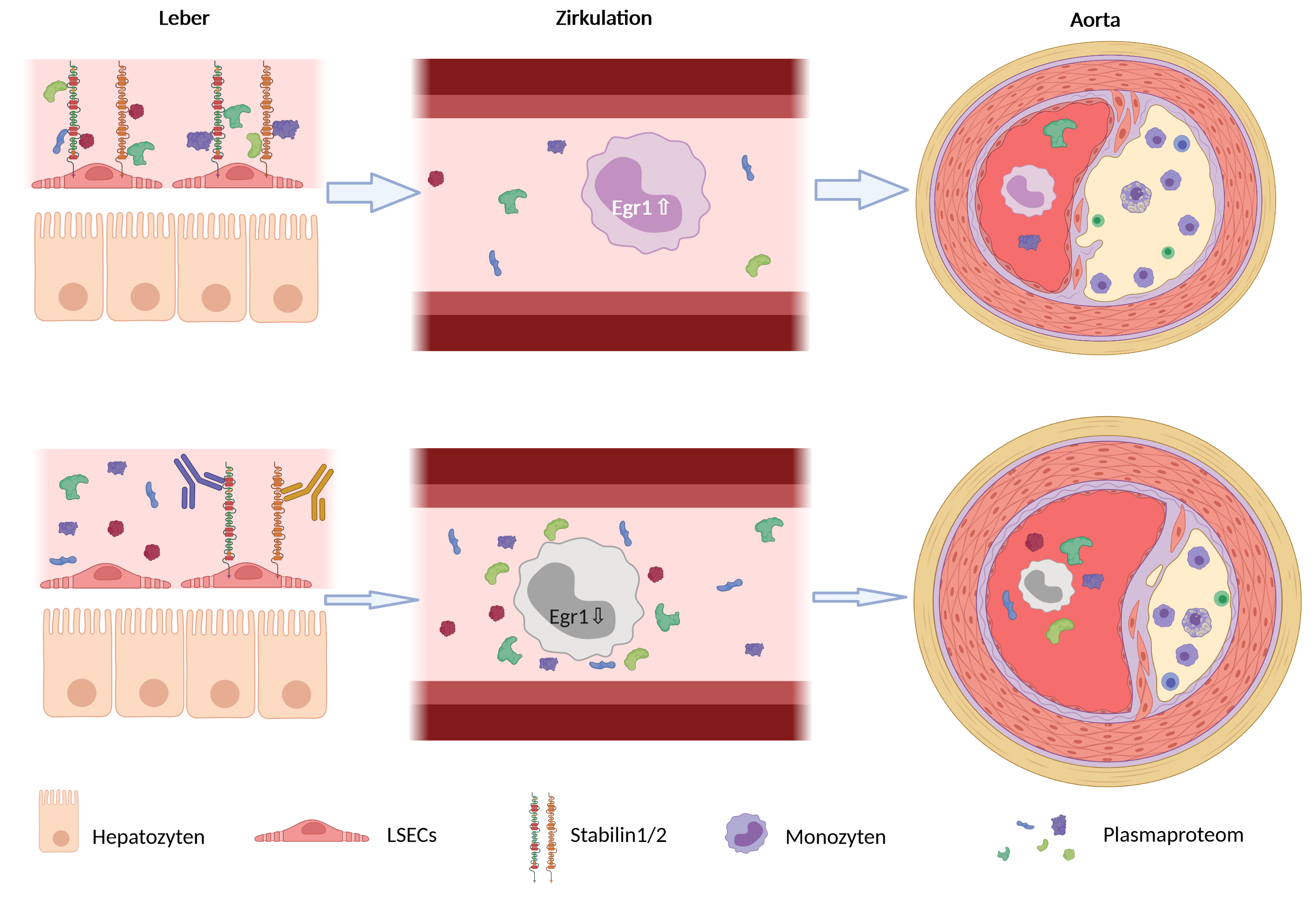
Das Team um Professor Dr. med. Cyrill Géraud (Leitender Oberarzt und Leiter der Sektion Klinische und Molekulare Dermatologie) und Prof. Dr. med. Sergij Goerdt (Direktor der Klinik für Dermatologie) untersuchte die Rolle der die Mikrogefäße der Leber auskleidenden Sinus-Endothelzellen bei der Entstehung von Atherosklerose im präklinischen Modell – an verschiedenen Mausmodellen für die Atherosklerose-Entstehung. Dabei entdeckten die Forscher, dass Stabilin-1 und Stabilin-2, zwei Rezeptoren, die sich vor allem auf Lebersinusoidendothelzellen finden, die Entwicklung von Atherosklerose beeinflussen.
Wird Stabilin-1 oder Stabilin-2 gehemmt oder ausgeschaltet, so vermindert sich die Atherosklerose-Entstehung signifikant. Dies zeigten die Forscher in zwei unterschiedlichen Ansätzen: Zum einen, indem sie die Rezeptoren gezielt mit monoklonalen Antikörpern gegen Stabilin-1 oder Stabilin-2 hemmten, zum anderen, indem sie durch Kreuzung Nachkommen von zu Atherosklerose neigenden ApoE-defizienten Mäusen erzielten, in denen Stabilin-1 oder Stabilin-2 mittels genetischer Ablation stillgelegt ist.
Den Mechanismus, wie Stabilin-1 und Stabilin-2 die Entwicklung von Atherosklerose befördern, erforschten die Wissenschaftler, indem sie das Plasmaproteom dieser verschiedenen Mauslinien gründlichen Analysen unterzogen. Über den Vergleich der Proteinausstattungen im Plasma von Wildtypmäusen und ApoE-defizienten Mäusen mit ihren Pendants ohne Stabilin konnten sie potenzielle Kandidaten ausmachen, die an dem Mechanismus beteiligt sind; einschließlich der Identifizierung neuer direkter Liganden von Stabilin, von denen bekannt ist, dass sie die Atherosklerose modulieren.
„Der starke Einfluss von Lebersinusendothelzellen über ihre Scavenger-Rezeptoren auf entfernte Organe ist bisher kaum beschrieben und ist ein recht neuartiges Konzept“, berichtet Dr. med. Thomas Leibing aus der Arbeitsgruppe von Professor Géraud und einer der beiden Erstautoren der Arbeit. „Nun konnten wir zeigen, dass eine Hemmung von Stabilin-1 und Stabilin-2 über Immunzellmodulation die Atheroskleroseentstehung hemmt.“ Mittels Einzelzell-RNA-Sequenzierung wiesen die Wissenschaftler nach, dass der Transkriptionsfaktor Egr1 durch Plasma von Mäusen ohne Stabilin unterdrückt wird. In vivo fanden sie eine verminderte Expression von Egr1 in zirkulierenden Monozyten.
„Die Hemmung von Stabilin bewirkt eine entzündungshemmende Veränderung des Plasmaproteoms. Das veränderte Plasmaproteom unterdrückt sowohl patrouillierende als auch entzündliche Monozyten. Stabilin stellt damit einen Schalter dar, der systemisch die Entwicklung von Atherosklerose kontrolliert“, erklärt Professor Dr. Cyrill Géraud.
„Eine zielgerichtete Therapie gegen Stabilin-1 oder Stabilin-2 könnte daher ein erfolgversprechender neuer Ansatz für die Behandlung der Atherosklerose sein“, so das Fazit von Professor Dr. Sergij Goerdt.
Die Arbeit ist aktuell im Journal „Circulation“, dem ranghöchsten Journal im Bereich der Kardiologie, veröffentlicht worden. Sie ist ein Kooperationsprojekt im Rahmen des Sonderforschungsbereichs 1366. Federführend waren daran die Arbeitsgruppen von Prof. Dr. Cyrill Géraud (B3) und von Prof. Dr. Sergij Goerdt (B2) beteiligt, die mit den Arbeitsgruppen von Prof. Dr. Michael Platten (C1) und Prof. Dr. Adelheid Cerwenka (C2) kooperierten.
Publikation
Targeting of Scavenger Receptors Stabilin-1 and Stabilin-2 Ameliorates Atherosclerosis by a Plasma Proteome Switch Mediating Monocyte/Macrophage Suppression
Calin-Petru Manta, Thomas Leibing, Calin-Petru Manta, Thomas Leibing, Mirco Friedrich, Hendrik Nolte, Monica Adrian, Kai Schledzewski, Jessica Krzistetzko, Christof Kirkamm, Christian David Schmid, Yannick Xi, Ana Stojanovic, Sarah Tonack, Carolina de la Torre, Seddik Hammad, Stefan Offermanns, Marcus Krüger, Adelheid Cerwenka, Michael Platten, Sergij Goerdt and Cyrill Géraud
Circulation 2022;146:1783-1799
DOI: 10.1161/CIRCULATIONAHA.121.058615