Biochemiker am Institute for Innate Immunoscience (MI3) der Medizinischen Fakultät Mannheim der Universität Heidelberg haben einen wichtigen Mechanismus der Qualitätskontrolle bei der Proteinbiosynthese entdeckt. Georg Stoecklin und sein Team konnten zeigen, dass die E3 Ubiquitin-Ligase RNF10 dafür sorgt, dass Störungen durch „liegengebliebene“ Ribosomen behoben werden, indem die Ribosomen von der mRNA abgelöst werden.
Zellen erkennen Störungen der Proteinbiosynthese
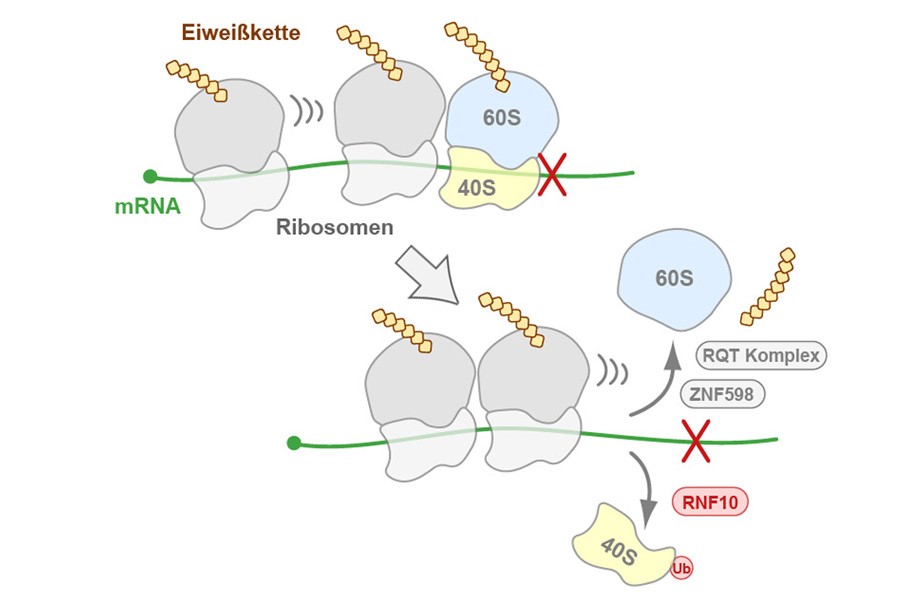
Proteine (auch Eiweiße genannt) werden in allen Zellen des Köpers durch sogenannte Ribosomen hergestellt. Diese „Proteinfabriken“ übersetzen den in den Boten-RNAs (englisch messenger RNA, mRNA) verschlüsselten genetischen Code in Aminosäuresequenzen. Dazu heften sich die beiden Untereinheiten der Ribosomen, 40S und 60S, an die mRNA an, und während das nun vollständige Ribosom an der mRNA entlangfährt, wird Aminosäure für Aminosäure entsprechend der Information auf der mRNA zusammenfügt. Die so gebildete Aminosäurekette faltet sich anschließend in das fertige Protein.
In den letzten Jahren hat die molekularbiologische Grundlagenforschung große Fortschritte im Verständnis der Prozesse erzielt, die dafür sorgen, dass Zellen Fehler während der Proteinbiosynthese erkennen und die Bildung fehlerhafter Proteine unterdrücken können. So weiß man zum Beispiel, dass Zellgifte, beschädigte Ribosomen oder defekte mRNAs dazu führen, dass Ribosomen beim Ablesen von mRNAs stehenbleiben, womit die Synthese von Proteinen unterbrochen ist. Da mRNAs von mehreren Ribosomen nacheinander abgelesen werden, führen solche Ribosomenstillstände zu regelrechten Kollisionen – vergleichbar einem Auffahrunfall auf der Autobahn.
Die E3 Ubiquitin-Ligase RNF10 übernimmt den Pannendienst
Bei der Behebung dieser Ribosomenunfälle übernehmen E3 Ubiquitin-Ligasen den Pannendienst, indem sie kollidierte Ribosomen gezielt erkennen und der kleinen ribosomalen Untereinheit 40S das Protein Ubiquitin anheften. Die so als fehlerhaft markierten Ribosomen werden anschließend in ihre beiden Untereinheiten zerlegt und damit für den Abtransport vorbereitet, womit der Weg für die nachfolgenden Ribosomen wieder frei wird.
Aus vorangegangenen Studien war bekannt, dass die Ubiquitinierung dazu beiträgt, dass die als fehlerhaft markierte 40S Untereinheit dem Abbau zugeführt wird. Vor diesem Hintergrund stellte sich Janina Lehmann im Team von Georg Stoecklin die Frage, welche Bedeutung RNF10 für das Wachstum von Zellen hat, und wie weitgehend die Funktion der Ubiquitin-Ligase RNF10 bei der Behebung von Ribosomenunfällen tatsächlich ist.
Das Team konnte zeigen, dass RNF10 nach Ribosomenstillstand in der Tat auch die Ablösung der 40S Untereinheit von der mRNA bewirkt (Details zum Mechanismus in der Abbildung). Diese Funktion hat RNF10 nicht nur dann, wenn die Proteinbiosynthese schon in vollem Gange ist und in der Mitte einer Aminosäurekette zum Stillstand kommt, sondern auch am Anfang der Synthese, wenn das Ribosom nach dem Beginn des genetischen Codes auf der mRNA sucht.
Resistenz gegenüber Bakteriengiften
Auf diesen Erkenntnissen aufbauend konnten die Forscher:innen zeigen, dass RNF10 dann besonders wichtig ist, wenn Zellen Bakteriengiften ausgesetzt sind, die zum Stillstand von Ribosomen führen. So konnten Zellen, die im Besitz von RNF10 sind, auch in Anwesenheit eines solchen Bakteriengifts wachsen, wohingegen Zellen ohne RNF10 unter diesen Bedingungen ihr Wachstum einstellten. Hier zeigt sich die grundlegende Bedeutung der Qualitätskontrolle während der Proteinbiosynthese, welche dafür sorgt, dass Zellen gegenüber schädigenden Umwelteinflüssen bis zu einem gewissen Grad resistent sind.
Funktion bei der Erhaltung des Gleichgewichts in der Ribosomenbiogenese
Im Laufe der Forschungsarbeit stieß das Team auf einen überraschenden Befund: Als die Bildung von ribosomalen 40S Untereinheiten experimentell gehemmt wurde, löste dies den Abbau von RNF10 aus. Umgekehrt führte die Hemmung der 60S Bildung zu einem Anstieg des RNF10 Spiegels. Dies deutet darauf hin, dass RNF10 auch an der Erhaltung des Gleichgewichts zwischen den 40S und 60S Untereinheiten währen der Ribosomenbiogenese beteiligt ist. Interessant ist dabei, dass die Neubildung von Ribosomen einer Steuerung unterliegt, welche direkt an die Funktionsprüfung von Ribosomen geknüpft ist. Hier zeigt sich, wie tief Qualitätskontrollen in allen zellulären Prozessen verankert sind.
Die grundlegenden Erkenntnisse aus dieser Studie ebnen den Weg für zukünftige Forschungsprojekte. Beispielsweise will man der Frage nachgehen, ob der beobachtete Einfluss von RNF10 auf das Zellwachstum bei einer Gruppe von Krankheiten, die durch genetisch vererbte Defekte in der Ribosomenbiogenese ausgelöst werden, eine Rolle spielt. Solche Defekte führen zu Blutarmut und tragen zur Entstehung von Krebs bei.
Publikation
Lehmann, J.A., Lindner, D., Sung, HM. et al.
E3 ubiquitin ligase RNF10 promotes dissociation of stalled ribosomes and responds to ribosomal subunit imbalance.
Nature Communication 15, 10350 (2024).
DOI: https://doi.org/10.1038/s41467-024-54411-x