Sie befinden sich hier
Inhalt
Forschung
Neurologie
Der neuroonkologische Forschungsschwerpunkt der Neurologischen Klinik hat die Weiterentwicklung von Immuntherapien für Patienten mit Hirntumoren, wie dem Glioblastom, zum Ziel.
In den letzten Jahren haben wir Schlüsselereignisse im Stoffwechsel der essentiellen Aminosäure Tryptophan als einen endogenen Mechanismus zur Hemmung von Immunreaktionen im Kontext der Hirntumoren sowie einen Schlüsselrezeptor für immunsuppressive endogene Tryptophan-Metabolite identifiziert. Diese Erkenntnisse haben einen neuen Blick auf die Rolle des Tryptophan-Stoffwechsels bei Krebserkrankungen sowie neue medikamentöse Angriffspunkte eröffnet, beispielsweise Inhibitoren des Arylhydrokarbonrezeptors (AHR). Im Rahmen eines kooperativen Projektes mit der Firma Bayer wurden AHR-Inhibitoren identifiziert und in präklinischen Modellen hinsichtlich ihrer anti-tumoralen Wirkung als Monotherapie und in Kombination mit sogenannten Immuncheckpoint-Inhibitoren validiert (Friedrich et al., Nat Cancer 2021; Kober et al., J Immunother Cancer 2023). Zwei Phase 1-Studien zur Therapie von Krebserkrankungen mit dem Ziel, die körpereigene Antitumorimmunität zu stärken, wurden 2023 abgeschlossen.
Weitere Untersuchungen befassen sich mit der Entdeckung neuer Ziel-Antigene für die Immuntherapie von einer Art von Hirntumoren, den Gliomen. In präklinischen Modellen wurden bereits die Immunogenität zentraler Gliom-spezifischer Mutationen nachgewiesen. Basierend auf den Arbeiten zum Nachweis der Immunogenität der Treiber-Mutation IDH1R132H (Bunse et al., J Clin Invest 2015; Schumacher et al., Nature 2014) wurde die multizentrische NOA-16-Studie abgeschlossen, in der die Sicherheit und Immunogenität einer IDH1R132H-spezifischen Peptidvakzine bei Patienten mit Gliomen nachgewiesen wurde. In der eigeninitiierten DKTK-geförderten multizentrischen NOA-21- Studie (Bunse et al., Neurol Res Pract 2022), deren Rekrutierung in 2023 abgeschlossen wurde, wird nun analysiert, ob die parallele Gabe des Checkpoint-Inhibitors Avelumab zu einer Wirkverstärkung der Peptidvakzine führt und welche intratumoralen Resistenzmechanismen die Effektivität dieses immuntherapeutischen Ansatzes beeinflussen. Hier wurden mit dem Nachweis der immunsuppressiven Effekte des Onkometaboliten 2-Hydroxyglutarat bereits erste Anhaltspunkte in präklinischen Modellen und Tumorgewebe gewonnen (Bunse et al., Nat Med 2018).
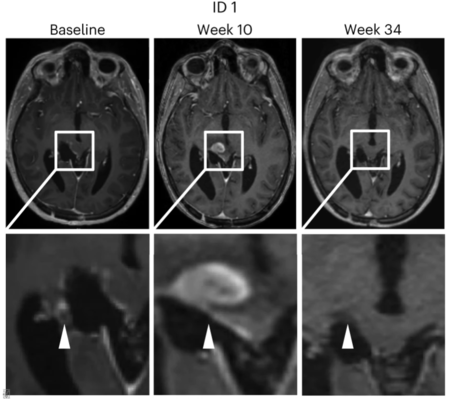
Darüber hinaus befassen wir uns mit der Erforschung weiterer Gliom-spezifischer Neoepitope wie H3K27M, vor allem mit der Identifikation spezifischer Rezeptoren auf neoepitopspezifischen T-Zellen, die in Patienten durch eine Vakzinierung aktiviert werden. Diese T-Zell-Rezeptoren sollen im Rahmen einer von der Deutschen Krebshilfe geförderten und gemeinsam mit TRON (Mainz) durchgeführten multizentrischen Phase 1-Studie INTERCEPT H3 (ClinicalTrials.gov identifier NCT04808245) in Patienten mit H3K27M-mutierten Gliomen nach einer Impfung gegen H3K27M kombiniert mit dem Checkpoint-Inhibitor Atezolizumab mit Hilfe von Einzelzellsequenzierungen gezielt identifiziert und einer funktionellen Testung zugeführt werden. Ziel ist die Verwendung solcher T-Zell-Rezeptoren für die Behandlung mit patientenautologen T-Zell-Rezeptor-transgenen T-Zellen mittels adoptivem Transfer. INTERCEPT H3 wurde bereits erfolgreich in die Klinik translatiert und erste Patienten werden in dieser Studie behandelt (Grassl et al., Neurol Res Pract 2023). Diese experimentelle Therapie wurde zudem bereits in acht Patienten mit diffusen Mittelliniengliomen wissenschaftlich ausgewertet (Grassl et al., Nat Med 2023) mit dem Ergebnis, dass sich diese Impfung als sicher erwies und die erwünschten gegen den Hirntumor gerichteten Immunreaktionen auslöste.
Intercept H3 Behandlungsschema. H3K27M-vac wird 15 Patienten mit neu diagnostiziertem diffusem Mittelliniengliom mit H3K27M-Mutation gleichzeitig mit einer Standardstrahlentherapie und anschließend in Kombination mit Atezolizumab verabreicht. Langfristige Blut- und Liquorproben werden Immunogenitätstests ermöglichen und dreimonatige MRT-Untersuchungen werden zusammen mit regelmäßigen klinischen Bewertungen zur Bestimmung des klinischen Ansprechens verwendet. Grassl et al., Neurol Res Pract 2023
Weitere Projekte im Rahmen von Verbundprojekten beschäftigen sich mit den immunmodulierenden Effekten von Strahlentherapie bei Hirntumoren (SFB 1366), Resistenzmechanismen gegenüber Checkpointinhibitoren bei Gliomen (SFB 1389) und Hirnmetastasen (GRK 2099), der Rolle von Makrophagen bei Gliomen (GRK 2727, SPP 2295) sowie dem Immunmikromilieu IDH-mutierter Gliome (EU Glioresolve). Im Rahmen des GRK 2727 konnten wir kürzlich zeigen, dass natürliche Killerzellen, eine Zellart des Immunsystems, die Wirkung von Krebstherapien mit Immun-Checkpoint Inhibitoren (ICI) beeinträchtigen kann (Kilian et al., Sci Immunol 2024).
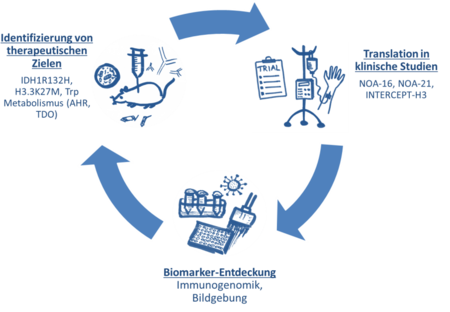
Iterativer Therapieentwicklungszyklus. IDH1R132H – Punktmutation im Isocitrat-Dehydrogenase Typ 1 Gen, H3.3K27M – Punktmutation im Histon-3 Gen H3F3A, Trp - l-Tryptophan, AHR – Aryl-Hydrocarbon-Rezeptor, TDO - Tryptophan-2,3-Dioxygenase.
Ausgewählte Publikationen
*equal contribution
1. Kilian M, Friedrich MJ, Lu KH, Vonhören D, Jansky S, Michel J, Keib A, Stange S, Hackert N, Kehl N, Hahn M, Habel A, Jung S, Jähne K, Sahm F, Betge J, Cerwenka A, Westermann F, Dreger P, Raab MS, Meindl-Beinker NM, Ebert M, Bunse L, Müller-Tidow C, Schmitt M, Platten M. The immunoglobulin superfamily ligand B7H6 subjects T cell responses to NK cell surveillance. Sci Immunol. 2024. 9(95):eadj7970.
DOI: 10.1126/sciimmunol.adj7970
2. Grassl N, Poschke I, Lindner K, Bunse L, Mildenberger I, Boschert T, Jähne K, Green EW, Hülsmeyer I, Jünger S, Kessler T, Suwala A, Sahm F, Eisele P, Breckwoldt MO, Vajkoczy P, Grauer OM, Herrlinger U, Tonn JC, Denk M, Bendszus M, von Deimling A, Winkler F, Wick W, Platten M*, Sahm K*. A H3K27M-targeted vaccine in adults with diffuse midline glioma. Nat Med. 2023. 29(10):2586-2592.
DOI: 10.1038/s41591-023-02555-6
3. Grassl N*, Sahm K*, Süße H, Poschke I, Bunse L, Bunse T, Boschert T, Mildenberger I, Rupp AK, Ewinger MP, Lanz LM, Denk M, Tabatabai G, Ronellenfitsch MW, Herrlinger U, Glas M, Krex D, Vajkoczy P, Wick A, Harting I, Sahm F, von Deimling A, Bendszus M, Wick W, Platten M. INTERCEPT H3: A multicenter phase I peptide vaccine trial for the treatment of H3-mutated diffuse midline gliomas. Neurol Res Pract. 2023. 5(1):55.
DOI: 10.1186/s42466-023-00282-4
4. Kilian M, Sheinin R, Tan CL, Krämer C, Friedrich M, Kaminitz A, Sanghvi K, Lindner K, Chih YC, Cichon F, Richter B, Jung S, Jähne K, Ratliff M, Prins R, Etminan N, von Deimling A, Wick W, Madi A*, Bunse L*, Platten M*. MHC class II-restricted antigen presentation is required to prevent dysfunction of cytotoxic T cells by blood-borne myeloids in brain tumors. Cancer Cell. 2023. 41:1-17.
DOI: 10.1016/j.ccell.2022.12.007
5. Kober C, Roewe J*, Schmees N, Roese L, Roehn U, Bader B, Stoeckigt D, Prinz F, Gorjánácz M, Roider HG, Olesch C, Leder G, Irlbacher H, Lesche R, Lefranc J, Oezcan-Wahlbrink M, Sati Batra A, Elmadany N, Carretero R, Sahm K, Oezen I, Cichon F, Baumann D, Sadik A, Opitz C, Weinmann H, Hartung IV, Kreft B, Offringa R, Platten M*, Gutcher I* (2023). Targeting the aryl hydrocarbon receptor (AhR) with BAY 2416964: a selective small molecule inhibitor for cancer immunotherapy. J Immunother Cancer. 2023. 11(11):e007495.
DOI: 10.1136/jitc-2023-007495.
6. Bunse L, Rupp AK, Poschke I, Bunse T, Lindner K, Wick A, Blobner J, Misch M, Tabatabai G, Glas M, Schnell O, Gempt J, Denk M, Reifenberger G, Bendszus M, Wuchter P, Steinbach JP, Wick W, Platten M. AMPLIFY-NEOVAC: a randomized, 3-arm multicenter phase I trial to assess safety, tolerability and immunogenicity of IDH1-vac combined with an immune checkpoint inhibitor targeting programmed death-ligand 1 in isocitrate dehydrogenase 1 mutant gliomas. Neurol Res Pract. 2022. 23;4(1):20. DOI: 10.1186/s42466-022-00184-x
7. Platten M, Bunse L, Wick A, Bunse T, Le Cornet L, Harting I, Sahm F, Sanghvi K, Tan CL, Poschke I, Green E, Justesen S, Behrens GA, Breckwoldt MO, Freitag A, Rother LM, Schmitt A, Schnell O, Hense J, Misch M, Krex D, Stevanovic S, Tabatabai G, Steinbach JP, Bendszus M, von Deimling A, Schmitt M, Wick W. A vaccine targeting mutant IDH1 in newly diagnosed glioma. Nature. 2021. 592:463-468.
DOI: 10.1038/s41586-021-03363-z
8. Friedrich M, Sankowski R, Bunse L, Kilian M, Green E, Ramallo Guevara C, Pusch S, Poschet G, Sanghvi K, Hahn M, Bunse T, Münch P, Gegner HM, Sonner JK, von Landenberg A, Cichon F, Aslan K, Trobisch T, Schirmer L, Abu-Sammour D, Kessler T, Ratliff M, Schrimpf D, Sahm F, Hopf C, Heiland DH, Schnell O, Beck J, Böttcher C, Fernandez-Zapata C, Priller J, Heiland S, Gutcher I, Quintana FJ, von Deimling A, Wick W, Prinz M*, Platten M*. Tryptophan metabolism drives dynamic immuno-suppressive myeloid states in IDH-mutant gliomas. Nat Cancer. 2021. 2:723-740.
DOI: 10.1038/s43018-021-00201-z
9. Aslan K, Turco V, Blobner J, Sonner JK, Liuzzi AR, Núñez NG, De Feo D, Kickingereder P, Fischer M, Green E, Sadik A, Friedrich M, Sanghvi K, Kilian M, Cichon F, Wolf L, Jähne K, von Landenberg A, Bunse L, Sahm F, Schrimpf D, Meyer J, Alexander A, Brugnara G, Röth R, Pfleiderer K, Niesler B, von Deimling A, Opitz CA, Breckwoldt MO, Heiland S, Bendszus M, Wick W, Becher B, Platten M. Heterogeneity of response to immune checkpoint blockade in hypermutated experimental gliomas. Nat Commun. 2020. 11:931.
DOI: 10.1038/s41467-020-14642-0
10. Bunse L, Pusch S, Bunse T, Sahm F, Sanghvi K, Friedrich M, Alansary D, Sonner JK, Green E, Deumelandt K, Kilian M, Neftel C, Uhlig S, Kessler T, von Landenberg A, Berghoff AS, Marsh K, Steadman M, Zhu D, Nicolay B, Wiestler B, Breckwoldt MO, Al-Ali R, Karcher-Bausch S, Bozza M, Oezen I, Kramer M, Meyer J, Habel A, Eisel J, Poschet G, Weller M, Preusser M, Nadji-Ohl M, Thon N, Burger MC, Harter PN, Ratliff M, Harbottle R, Benner A, Schrimpf D, Okun J, Herold-Mende C, Turcan S, Kaulfuss S, Hess‐Stumpp H, Bieback K, Cahill DP, Plate KH, Hänggi D, Dorsch M, Suvà ML, Niemeyer BA, von Deimling A, Wick W, Platten M. Suppression of antitumor T cell immunity by the oncometabolite R-2-hydroxyglutarate. Nat Med. 2018. 24:1192-1203.
DOI: 10.1038/s41591-018-0095-6
11. Bunse L, Schumacher T, Sahm F, Pusch S, Oezen I, Rauschenbach K, Gonzalez M, Solecki G, Osswald M, Capper D, Wiestler B, Winkler F, Herold-Mende C, von Deimling A, Wick W, Platten M. Proximity ligation assay evaluates IDH1R132H presentation in gliomas. J Clin Invest. 2015. 125:1-14.
DOI: 10.1172/JCI77780
12. Schumacher T, Bunse L, Pusch S, Sahm F, Wiestler B, Quandt J, Menn O, Osswald M, Oezen I, Ott M, Keil M, Balß J, Rauschenbach K, Grabowska AK, Vogler I, Diekmann J, Trautwein N, Eichmüller SB, Okun J, Stevanović S, Riemer AB, Sahin U, Friese MA, Beckhove P, von Deimling A, Wick W, Platten M. A vaccine targeting mutant IDH1 induces antitumour immunity. Nature. 2014. 512:324-327.
DOI: 10.1038/nature13387
13. Opitz CA, Litzenburger UM, Sahm F, Ott M, Tritschler I, Trump S, Schumacher T, Jestaedt L, Schrenk D, Weller M, Jugold M, Guillemin GJ, Miller CL, Lutz C, Radlwimmer B, Lehmann I, von Deimling A, Wick W, Platten M. An endogenous ligand of the human aryl hydrocarbon receptor promotes tumor formation. Nature 2011. 478:197-203.
DOI: 10.1038/nature10491
14. Platten M, Ho PP, Youssef S, Fontoura P, Garren H, Hur EM, Gupta R, Lee LY, Kidd BA, Robinson WH, Sobel RA, Selley ML, Steinman L. Treatment of autoimmune neuro-inflammation with a synthetic tryptophan metabolite. Science. 2005. 310:850-855.
DOI: 10.1126/ science.1117634
Förderinstitutionen
Deutsche Forschungsgemeinschaft (DFG)
Deutsche Krebshilfe
Helmholtz Gemeinschaft
Dr. Rolf M. Schwiete Stiftung
Wilhelm Sander Stiftung
Bundesministerium für Bildung und Forschung (BMBF)
Gemeinnützige Hertie Stiftung
European Union
Forschungsallianzen
DKFZ-Hector Krebsinstitut an der Universitätsmedizin Mannheim
Deutsches Krebsforschungszentrum (DKFZ)
Deutsches Konsortium für Translationale Krebsforschung (DKTK)
Hertie Network of Excellence in clinical neuroscience
Heidelberg University Hospital
HI-TRON Mainz
Helmholtz Immunology & Inflammation
Kontextspalte

EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood
Weller, M., van den Bent, M., … Platten, M., et al., Nat Rev Clin Oncol (2021).
https://doi.org/10.1038/s41571-020-00447-z